- Fyzika
- Skupenství Látek
- Atomy A Molekuly
- Fyzikální Veličiny
- Magnetismus
- Čas
- Hmotnost A Gravitace
- Rozměry Těles
- Teplota
- Elektrické Vlastnosti Látek
- Elektrický Obvod
- Pohyb Tělesa
- Síly A Jejich Vlastnosti
- Kapaliny
- Plyny
- Atmosféra Země
- Světelné Jevy, Optika
- Rychlost
- Těžiště
- Akce A Reakce
- Tření
- Archimédův Zákon
- Pascalův Zákon
- Pevné Látky
S prvními názory na stavbu hmoty se setkáváme již u řeckých filozofů Democritus a Leukippa. Zavedly pojem atom. Atomy jsou nedělitelné, nezničitelné a neustále se pohybují v prázdném prostoru. Tyto úvahy nebyly podloženy pozorováním ani pokusy a nedočkali se všeobecného uznání.
Na začátku 19. století zformuloval John Dalton ATOMOVOU TEORIE:
Přímý důkaz existence atomů však dlouho chyběl. Přinesli ho až vědecké výzkumy v 20. století. Potvrdily nejen existenci atomů, ale také fakt, že atomy nejsou nejmenší částice hmoty, a že mají složitou vnitřní strukturu, na níž se podílejí elementární částice.
Atom se skládá z
Nejlehčí způsob, jak si představit atom, je model sluneční soustavy. Počet elektronů se obvykle rovná počtu protonů.
Otázky, které byste mohli mít:
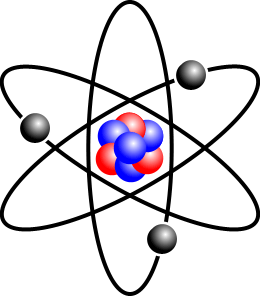 Solární systém model sluneční soustavy model atomu je, že atom je jako malá sluneční soustava, s jádrem v centru a elektrony rotující kolem jádra na oběžných drahách, podobně jako planety točí kolem Slunce. To je také nazýváno Bohrův model, po Neils Bohr, který objevil elektronové skořápky v roce 1913.
Solární systém model sluneční soustavy model atomu je, že atom je jako malá sluneční soustava, s jádrem v centru a elektrony rotující kolem jádra na oběžných drahách, podobně jako planety točí kolem Slunce. To je také nazýváno Bohrův model, po Neils Bohr, který objevil elektronové skořápky v roce 1913.
Není zcela jisté, zda se skutečně elektrony rotují kolem jádra, nebo stojí na místě, ale je pravděpodobné, že jsou v pohybu.
Jádro
jádro se skládá z několika pozitivně nabitých protonů a neutronů nenabité. Jsou přibližně stejné velikosti a hmotnosti.
Uvnitř jádra existuje jakýsi druh "jaderného lepidla", které drží jádro pohromadě. Musí tam být obvykle více neutronů než protonů, aby jádro bylo stabilní. Současné teorie říkají, že je tam sub-nukleární částice zvané gluon, která drží jádro pohromadě.
Elektron
Aby atom byl elektricky stabilní, má stejný počet záporně nabitých elektronů na oběžné dráze kolem jádra jako kladně nabité protony uvnitř jádra. V případě, že množství elektronů je méně nebo více, atom se nazývá iont.
Elektronové vrstvy
Elektrony jsou uspořádány do skořápky nebo na oběžných drahách kolem jádra.
Maximální počet
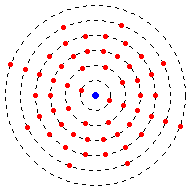 Uspořádání a maximální počet elektronů na těchto drahách je odlišné a závisí na tom, v jaké vrstvě se nacházejí.
Uspořádání a maximální počet elektronů na těchto drahách je odlišné a závisí na tom, v jaké vrstvě se nacházejí.
Nejvíce možných elektronů v první skořápce jsou 2. Když je první skořápka vyplněna, druhá začne se plnit druhá skořápka v závislosti na počtu kladných nábojů v jádře. Nejvíce možnýchn elektronů ve druhém vrstvě (skořápce) je 8 elektronů. Pak začíná třetí atd..
Energetické hladiny
Elektrony mají v sobě potenciální energie, v závislosti na jejich skořápkách. Energetické hladiny jsou přiřazeny každé oběžné dráze. Existuje několik situací, kdy elektron bude skákat z jedné oběžné dráhy (nebo energetické hladiny) do jiné. Když se to stane, elektron vydá elektromagnetické energie z jedné vlnové délky nebo barvy světla.
Vzhledem k tomu, že každý prvek má své vlastní elektronové vrstvy nebo energetické vlastnosti, má také svou vlastní sadu barev pro možné skoky mezi elektronové dráhy. Tato teorie se používá při identifikaci prvků, které dávají světlo.
Shrnutí
Sluneční soustava je dobrý způsob, jak popsat atom. Jádro je ve středu atomu a skládá se z protonů a neutronů. Tam je obvykle jen tolik elektronů jako protonů v atomu. Elektrony jsou distribuovány ve skořápkách kolem jádra podle určitých pravidel. Vnější plášť je velmi důležité pro chemii.
Na začátku 19. století zformuloval John Dalton ATOMOVOU TEORIE:
- prvky jsou složeny z malých částic - atomů, atomy jednoho prvku jsou stejné, atomy různých prvků se liší vlastnostmi
- při chemických reakcích dochází ke spojování, oddělování a přeskupování atomů, atomy při nich nevznikají, nemizí ani nemění na atomy jiných prvků
- spojováním atomů dvou nebo více prvků vznikají nové látky - sloučeniny
- v určité sloučenině připadá na jeden atom jistého prvku vždy stejný počet atomů jiného prvku
Přímý důkaz existence atomů však dlouho chyběl. Přinesli ho až vědecké výzkumy v 20. století. Potvrdily nejen existenci atomů, ale také fakt, že atomy nejsou nejmenší částice hmoty, a že mají složitou vnitřní strukturu, na níž se podílejí elementární částice.
Atom se skládá z
jádra (je složeno z protonů / p+ / a neutronů / n0 /)
obalu (je složen z elektronů / e-/)
obalu (je složen z elektronů / e-/)
| Částice | Označení | Hmotnost (kg) |
Náboj |
| Elektron | e- | 9,106 * 10-31 |
-1 |
| Proton | p+ | 1,672 * 10-27 |
1 |
| Neutron | n0 | 1,68 * 10-27 |
0 |
Nejlehčí způsob, jak si představit atom, je model sluneční soustavy. Počet elektronů se obvykle rovná počtu protonů.
Otázky, které byste mohli mít:
- Co je ve sluneční soustavě model atomu?
- Jak je vypadá jádro?
- Co jsou to elektronové vrstvy?
 Solární systém model sluneční soustavy model atomu je, že atom je jako malá sluneční soustava, s jádrem v centru a elektrony rotující kolem jádra na oběžných drahách, podobně jako planety točí kolem Slunce. To je také nazýváno Bohrův model, po Neils Bohr, který objevil elektronové skořápky v roce 1913.
Solární systém model sluneční soustavy model atomu je, že atom je jako malá sluneční soustava, s jádrem v centru a elektrony rotující kolem jádra na oběžných drahách, podobně jako planety točí kolem Slunce. To je také nazýváno Bohrův model, po Neils Bohr, který objevil elektronové skořápky v roce 1913.Není zcela jisté, zda se skutečně elektrony rotují kolem jádra, nebo stojí na místě, ale je pravděpodobné, že jsou v pohybu.
Jádro
jádro se skládá z několika pozitivně nabitých protonů a neutronů nenabité. Jsou přibližně stejné velikosti a hmotnosti.
Uvnitř jádra existuje jakýsi druh "jaderného lepidla", které drží jádro pohromadě. Musí tam být obvykle více neutronů než protonů, aby jádro bylo stabilní. Současné teorie říkají, že je tam sub-nukleární částice zvané gluon, která drží jádro pohromadě.
Elektron
Aby atom byl elektricky stabilní, má stejný počet záporně nabitých elektronů na oběžné dráze kolem jádra jako kladně nabité protony uvnitř jádra. V případě, že množství elektronů je méně nebo více, atom se nazývá iont.
Elektronové vrstvy
Elektrony jsou uspořádány do skořápky nebo na oběžných drahách kolem jádra.
Maximální počet
 Uspořádání a maximální počet elektronů na těchto drahách je odlišné a závisí na tom, v jaké vrstvě se nacházejí.
Uspořádání a maximální počet elektronů na těchto drahách je odlišné a závisí na tom, v jaké vrstvě se nacházejí.Nejvíce možných elektronů v první skořápce jsou 2. Když je první skořápka vyplněna, druhá začne se plnit druhá skořápka v závislosti na počtu kladných nábojů v jádře. Nejvíce možnýchn elektronů ve druhém vrstvě (skořápce) je 8 elektronů. Pak začíná třetí atd..
Energetické hladiny
Elektrony mají v sobě potenciální energie, v závislosti na jejich skořápkách. Energetické hladiny jsou přiřazeny každé oběžné dráze. Existuje několik situací, kdy elektron bude skákat z jedné oběžné dráhy (nebo energetické hladiny) do jiné. Když se to stane, elektron vydá elektromagnetické energie z jedné vlnové délky nebo barvy světla.
Vzhledem k tomu, že každý prvek má své vlastní elektronové vrstvy nebo energetické vlastnosti, má také svou vlastní sadu barev pro možné skoky mezi elektronové dráhy. Tato teorie se používá při identifikaci prvků, které dávají světlo.
Shrnutí
Sluneční soustava je dobrý způsob, jak popsat atom. Jádro je ve středu atomu a skládá se z protonů a neutronů. Tam je obvykle jen tolik elektronů jako protonů v atomu. Elektrony jsou distribuovány ve skořápkách kolem jádra podle určitých pravidel. Vnější plášť je velmi důležité pro chemii.